撰文 | clefable
审校 | 黄雨佳
一个健康的人不会一直清醒,也无法永久沉睡,我们的生命就像被强制约束在两者之间。无论我们设法更靠近哪一端,似乎都离死亡近了一些。
除了徘徊在清醒和沉睡之间,大部分生命还有一项不得不进行的活动:有氧呼吸和能量代谢。如果你询问有氧呼吸和睡眠之间的联系,一些人会说它们是维系生命的基础活动。但如果你问英国牛津大学神经回路与行为中心(CNCB)的主任格罗·米森伯克(Gero Miesenböck),他会告诉你:有氧代谢是需要睡眠的根本原因。

米森伯克拥有十分出彩的科研履历。早在23年前,他的研究团队就率先在光遗传学领域取得突破:他们将一组视蛋白基因导入了大鼠的神经元,结果发现用光照射这些改造后的神经元,可以让它们发出电脉冲。数年后,他和同事又将光敏离子通道植入果蝇大脑深处,并用光精确刺激其中的两个神经元来控制果蝇飞行。这些都显示了光遗传学彻底改变神经科学研究的潜力。
如今,随着光遗传学在神经科学领域的广泛应用,它几乎揭示了大脑的所有功能:感觉与运动,动机与学习,以及沟通与决策等。从2012年开始,米森伯克作为光遗传学的先驱之一,成了各大科学奖项的常客。“光遗传学”也成了诺贝尔奖的热门候选学科,或许未来还将为他的履历再添辉煌的一笔。而另一边,米森伯克又带着他的长期实验伙伴——果蝇,深入到了睡眠研究中。
睡眠倒计时
人类有很多睡眠习惯,比如到点会犯困,以及平时睡不够就要周末补觉。目前一个被普遍接受的理念是,睡眠由两个生理学过程控制,分别是生物钟(也称为昼夜节律)和睡眠稳态系统。

人体的主生物钟是下丘脑的视交叉上核,它可以接收视网膜传来的光信号,让我们的昼夜节律与周围环境相统一。与此同时,它会进一步协调身体器官和组织中的生物时钟,让我们可以跟随昼夜节律调整睡眠、昼夜代谢和免疫反应等。
睡眠稳态系统主要控制睡眠强度和时间。比如,你因一周工作严重缺觉,睡眠稳态系统就会在周末制造睡眠反弹,让你睡更长时间,得到充足的休息。在果蝇体内,这个系统中的关键脑区名为背侧扇形体(dorsal fan‑shaped body,dFB)。一部分科学家认为,人脑中的腹外侧视前区(VLPO)具有相似的功能。
研究人员之间的另一个共识是,人、小鼠等哺乳动物和果蝇在睡眠控制和调节上具有高度保守性。虽然乍一看,人和果蝇的睡眠环境截然不同:同样是每天需要约8小时的睡眠,人睡觉时需要安全、安静的环境,而果蝇只是在一个地方安静地静止。

科学家注意到,dFB开始兴奋时,果蝇睡眠就开始了。这个脑区会向果蝇大脑的其他脑区发送睡眠信号,诱导果蝇入睡。6年前,在一篇发表于《自然》(Nature)的论文中,米森伯克和同事发现,dFB就像是睡眠的坚定守护者。白天大脑清醒时,大部分神经元都十分活跃,它们会摄入能量,传递神经信号,对外界刺激作出精确的反应。但在这一期间,dFB中的神经元却会受到抑制,极不活跃——这般逆向操作就像是一个倒夜班的人,但一到睡觉的点,dFB“上班了”,它就会启动睡眠。
精密的传导
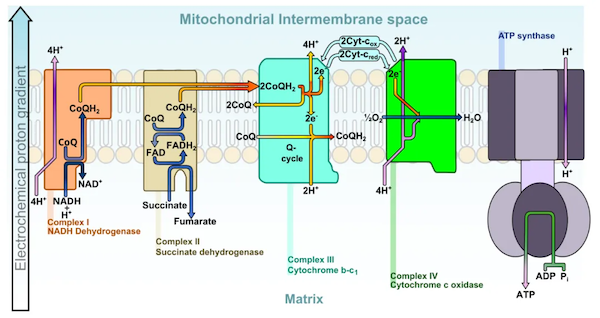
dFB引发睡眠的整个过程,像是一条精确的传导链条。白天,果蝇会摄入大量食物,为神经元提供充足的能源物质,神经元中的线粒体代谢这些能源物质,主要是经由氧化呼吸链中的4个复合体(见下图)传递氢和电子,合成大量可以直接使用的ATP。dFB神经元也会如此。
但关键在于,dFB神经元在白天极不活跃,消耗的ATP不多,因此这些ATP就会剩余,然后越积越多。这有点像排队上下楼梯的过程,最前方的ATP无法被及时消耗,堵在了那里,整个氧化呼吸链就会堵塞,长时间停滞。这时,在呼吸链中容易泄漏电子的复合体3,就会更容易将电子泄露出去。这些电子会被氧气接收,形成超氧化物(⋅O2−)——这也是睡眠倒计时的起始点。
其实,这种拥堵带来的氧化压力仍在dFB的掌控之中。这种压力会在dFB神经元内一直传递,直到拨动一个新的开关——位于细胞膜上的一种电压门控钾离子通道。具体而言,这种氧化压力会作用到离子通道上的一种酶上。
这种酶一直会和NADPH(还原型辅酶Ⅱ,在很多反应中负责传递氢)结合,但当NADPH被氧化成NADP+,这个酶就会发生改变。这个改变是决定性的,它会让这种钾离子通道长时间打开,提高dFB神经元的自发放电频率,让dFB神经元进入活跃状态。这是,dFB神经元会向其他脑区发送信号,让它们开始休息,果蝇就进入了睡眠。
全脑氧化
然而,如果困意袭来却无法按时睡觉,会如何呢?今年3月和7月,米森伯克的团队再次在《自然》上发表了两篇论文,为2019年的研究补充了更多细节,也揭示了睡眠剥夺(或者熬夜)对大脑的伤害。
在今年3月的研究中,他们发现dFB神经元线粒体产生的超氧化物会率先氧化细胞内部的不饱和脂肪酸。他们分析了近3000个果蝇的大脑神经元,发现睡眠剥夺12小时(相当于熬一个通宵)后,神经元细胞膜表面的380种甘油磷脂中有多达51种的数量会增加或减少了两倍以上。
如果是正常休息,果蝇大脑中数量最多的4种甘油磷脂的脂肪酸链均是长链且高不饱和状态(双键数平均为5个,最高有12个)。然而,一旦经历睡眠剥夺,主要的甘油磷脂种类会变少,它们的脂肪酸链不仅会变短,且双键数量也会明显减少(平均双键数只有2个)。
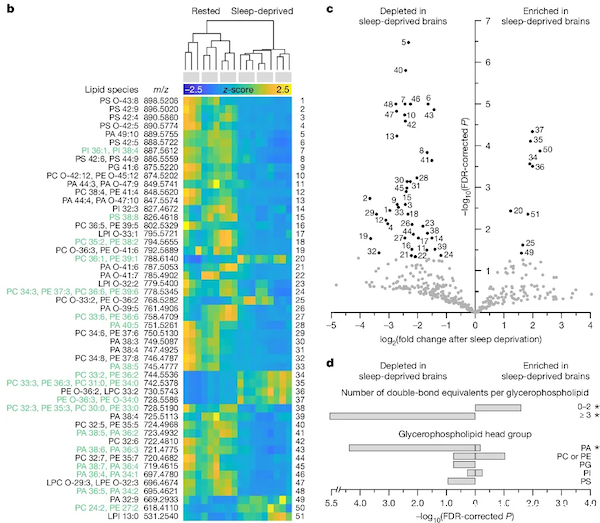
也就说,熬大夜会让甘油磷脂多样性变少、脂肪链变短,这会导致细胞膜的刚性变差,抗氧化能力显著下降。这些都是超氧化物破坏的结果,暗示果蝇大脑已经进入了全脑氧化的状态。
清醒时,大脑中大量活跃的神经元都在快速氧化供能,但会有电子泄漏,造成氧化,但不像dFB这么明显。因此,当dFB因氧化压力大促进睡眠时,也会让大脑的其他区域开始休息和修复,避免出现严重的氧化。
这项研究也揭开了撬动睡眠的“真凶”——4-氧代-2-壬烯醛(4-ONE)。研究人员发现,被氧化的甘油磷脂会生成脂质氢过氧化物(LOOH)。而LOOH经过裂解和重排,最终会产生各种短链或长链的醛和酮等,其中就有4-ONE。4-ONE达到细胞膜后,会将钾离子通道的NADPH氧化成NADP+,让dFB开始变得兴奋。
线粒体先破碎,后减少
除了导致全脑氧化之外,熬大夜或睡眠剥夺还有一个严重的后果,那就是让线粒体裂开,数量也急剧下降。米森伯克团队发现,在被睡眠剥夺12小时的果蝇中,dFB神经元内的线粒体会发生明显改变。今年7月,他们将这一发现发表在了《自然》上。
2025年7月,《伟德手机app下载安装官网》杂志的封面文章曾写道,在活细胞、器官甚至更广泛的人体中,线粒体会构成一个动态的网络,它们之间会相互通信,互相帮助。而早在2008年,一篇发表于《欧洲分子生物学学会杂志》(The EMBO Journal)的研究就发现,线粒体本会通过分裂和融合不断重塑,这是一个相对正常的过程——不过前提是正常睡觉。
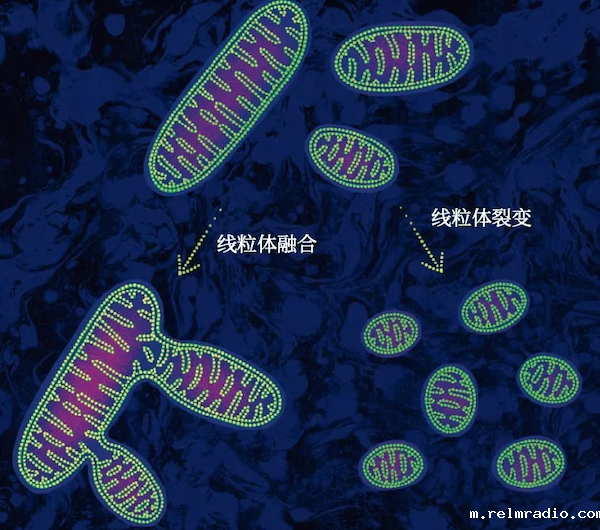
而在睡眠被剥夺或者熬大夜时,dFB中的线粒体分裂更像是一种无奈之举。它们不得不通过分裂,清除掉那些因氧化而出现功能异常的部分——损坏的部分进入回收系统。这些变小的线粒体也没有办法重新融合,因为睡眠剥夺已经损耗了帮助它们融合的关键磷脂酸。
好在,这些变小的线粒体会向内质网求助,从内质网那里拿来磷脂,修补线粒体膜,从而将线粒体整体维持在相对健康的水平,但数量却显著减少。

如果继续维持清醒,这些变小的线粒体就不得不重新整装待发。随着新一轮的能量物质到来,氧化呼吸链又会进一步堵塞,新一轮的活性氧破坏也即将到来。
修复氧化,能量重启
我们体内每天都会因有氧代谢而持续产生活性氧,持续伤害神经元,让它们进入“战损”状态。因此,我们虽然能勉强维持一个白天的学习和思考,但更长时间恐怕难以为继。如果我们将活性氧的破坏推向极端,也不难想象为何一直不睡觉会导致死亡。
大量研究都显示,睡眠具有很多独特的功能:恢复能量水平,合成组织再生的生物分子,以及清除自由基。而在睡眠带来的恢复期,我们身体的代谢率会降低约5%~15%,大脑的葡萄糖代谢也会降低。此时,大脑可以清除活性氧(ROS)等代谢废物,并补充能量储备。另一方面,睡眠也会促进抗氧化剂的产生,包括褪黑激素以及抗氧化酶超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶,帮助清除自由基,这些都会帮助改善线粒体的健康。
在神经系统中,神经元和星形胶质细胞中的线粒体是活性氧的主要来源,少量的ROS可以微调神经递质的释放,甚至增强学习和记忆等认知功能。然而,由于大脑处于高耗氧量和富含脂质的环境,当ROS水平过高,大脑无法抵抗时,就会特别容易受到氧化应激的影响。
在7月《自然》论文的讨论部分,米森伯克和同事将睡眠的起源一直推演到了有氧代谢的出现:在24亿年前的大氧化事件中,真核生物第一次做到了最大限度地从有机物中获得能量;而从7.5亿至5.7亿年前,地球上的又一次大氧化事件则为寒武纪生命大爆发奠定了基础。
有了提供高能量的氧化代谢,就有了高耗能的神经系统,随之而来的就是对睡眠的需求。不过睡眠也在演化中被充分利用,例如我们也能用睡眠来巩固记忆、恢复情绪调节等等。但睡眠最基本的功能仍是修复代谢带来的损伤,保证新一天,我们能以全新的精神呼吸新鲜空气。
抱歉这篇文章增加了你大脑的氧化程度,祝你今晚睡眠很好。
参考链接:
https://www.science.org/doi/full/10.1126/sciadv.adx5372
https://www.annualreviews.org/content/journals/10.1146/annurev-earth-031920-081957
https://www.newscientist.com/article/2490993-deep-living-microbes-could-eat-energy-generated-by-earthquakes/
https://www.eurekalert.org/news-releases/1091679
https://baijiahao.baidu.com/s?id=1838180001329756894
]]>

撰文 | clefable
审校 | 冬鸢
1918年,当一战的形势逐渐明朗时,著名的物理学家爱因斯坦收到一位女性朋友的委托,希望他写信劝劝她当时在一个精锐骑兵团担任医生的儿子——让他重回学术界。这位母亲认为,失去儿子的才能会是这个世界的悲剧。13年后,这位医生不负所望,成为了当年唯一的诺贝尔生理学或医学奖的获得者。这个擅长马术的医生正是德国生物化学家奥托·海因里希·瓦尔堡(Otto Heinrich Warburg),他因为发现线粒体中“呼吸酶的性质和作用方式”于1931年获得了诺奖。

瓦尔堡的一生共获得了47次诺奖提名,而他在一生中都在研究两个基本的生物学问题:生命的能量是什么?以及癌细胞和正常细胞在代谢上的差异。如今来看,瓦尔堡极富远见,癌细胞的能量代谢至今都是科学界最受关注的领域之一。20世纪20年代,瓦尔堡曾发现癌细胞可以进行有氧糖酵解——在有氧的情况下,也能吸收大量葡萄糖产生乳酸。这个过程在它们的细胞质中进行,因此不需要线粒体,可以产能更快,可以让癌细胞实现快速增长。
当时,瓦尔堡认为,这是由于癌细胞线粒体异常或者缺陷导致的。不过后续的一些研究显示,癌细胞的线粒体可能并不会有明显缺陷,反而是缺少线粒体,会让它们的致癌性降低。一个观点则认为,肿瘤细胞拥有代谢可塑性,可以在糖酵解和氧化磷酸化(需要线粒体,产能更多)之间切换,以适应不同的生存挑战。
相比之下,人体内正常的细胞则非常依赖线粒体供能,而癌细胞似乎不仅知道这一点,还以此发现了打倒抗癌的T细胞的方式。3年前,美国哈佛医学院的副教授Shiladitya Sengupta的研究团队在《自然·生物技术》(Nature Biotechnology)上发表了一项研究。他们发现,癌细胞的体表会伸出多个“大手”,即长的纳米管道,以连接T细胞。这个举动充满敌意,它们会通过管道,偷走T细胞的线粒体。(点击阅读:首次发现:癌细胞竟能“伸出大手”,掏走免疫细胞的线粒体!)
科学家认为癌细胞对免疫细胞使出了一招“釜底抽薪”,而随着T细胞被“偷家”,它们也会失去战斗能力,从此一蹶不振。

或许是看到T细胞过于惨兮兮,今年9月,Sengupta的研究团队又在《细胞》(Cell)上发表了一篇论文。这次,他们为T细胞找到了一个能为其“超能充电”的后援。那么获得超能状态的T细胞对战癌细胞,胜算又有几何呢?
T细胞:完蛋,血条掉完了
当T细胞到达肿瘤周围时,肿瘤微环境中的多种分子,就会开始抑制T细胞的活性。而之后,T细胞更是会被偷走一些供能的线粒体,变得举步维艰,很快便走向了衰竭。这有点像是在反派大佬的压迫下,顶尖高手的装备、血量一顿狂掉,最后各种修炼的绝招完全没有机会发挥出来。

而这个过程似乎是不可逆的。科学家就曾发现如果将细胞中的线粒体全部去除,它们就无法产生新的线粒体。这个现象可以追溯到真核细胞中线粒体的起源。线粒体是真核细胞中一个关键的细胞器,内共生假说和现有的基因数据都证实,线粒体可能起源于阿尔法变形菌。线粒体也只能通过二元裂变形成,这正是细菌和古细菌使用的细胞分裂形式。
不过就算癌细胞会偷家,也不是全然没有希望。一些研究人员就观察到,一些细胞的线粒体可以转移到受损细胞中,促进受损细胞修复。这也让研究人员产生了一种新想法,给T细胞也输点线粒体,让它们恢复战斗力。
线粒体:一种战略资源
线粒体转移最主要的方式之一就是利用纳米管道。这种纳米管是细胞利用F-肌动蛋白形成的膜突起,它可以跨越很远的距离来桥接两个细胞。在这项新研究中,Sengupta和同事发现在人和小鼠体内,一种存在于人骨髓中的多能干细胞——骨髓间充质干细胞(BMSC)和CD8+ T细胞之间都会存在复杂的纳米管。其中BMSC会参与调节T细胞的功能和分化。

为了确定BMSC是否会向CD8+ T细胞输送线粒体,研究人员用人和小鼠的细胞分别进行了实验。他们先用红色荧光蛋白(DsRed)标记了BMSC中线粒体的亚基蛋白,再将BMSC和CD8+ T细胞共培养24小时后。结果发现,部分人和小鼠的CD8+ T细胞出现了红色荧光蛋白的信号。
研究人员还使用鬼笔环肽-绿色荧光(Phalloidin Green)对BMSC和CD8+ T细胞的F -肌动蛋白进行标记。当他们放大纳米管上的一些细节时,有了一个预期中的发现:绿色荧光的下面,有红色荧光标记的线粒体在移动。这也证实了研究人员的猜测,线粒体可以借由纳米管道,从BMSC运输到CD8+ T细胞。

如果说,癌细胞和T细胞之间的纳米管是吸走T细胞能量的“巨大吸管”。那么,BMSC和CD8+ T细胞之间的则是一条紧急救援纳米管道,而在这些纳米管道的构建中,关键的TLN2基因发挥了重要作用。在CD8+ T细胞或BMSC中的TLN2缺失,都足以显著损害线粒体转移率。在BMSC中,这种影响尤为显著。
上擂台,“超能”T细胞!
线粒体的一个关键任务是通过有氧呼吸产生能量。研究人员发现,当CD8+ T细胞接受线粒体,会变身为拥有更高基础呼吸的“超能”T细胞,其备用呼吸能力(SRC)也会提高,可以帮助T细胞应对高能量代谢的情况。
而这些“超能”T细胞更能有效地进入肿瘤内部,而那些正常的T细胞仍然会被排除在肿瘤之外,只能在肿瘤外围发挥功能。在线粒体的加持下,这些“超能”T细胞的代谢率也不会受到肿瘤的明显影响。
小鼠实验显示,拥有“超能”T细胞的患癌小鼠的生存时间明显更长。这些“超能”T细胞在肿瘤微环境中更加活跃,发挥出了真正的杀伤能力,可以让肿瘤消退更快。研究人员表示,BMSC的线粒体对对抗肿瘤的CD8+ T细胞产生了深远的影响:让这些“超能”T细胞的存活率增加,拥有了强劲的、在肿瘤中扩张的能力。与此同时,它们对肿瘤引起的耗竭有了更强的抵抗力,且能变身为更具杀伤能力的“杀手”——高度特化的细胞毒性效应细胞。

更令人惊喜的是,这个效果并不是短暂的,而是可以长期存在。这些“超能”T细胞获得的线粒体可以通过重复分裂,传递给它们的子细胞。在转移过程发生1个月后,“超能”T细胞仍然拥有更多的线粒体。
这是一辆赛车
9月27日,一项发表于《转化医学杂志》(Journal of Translational Medicine)的研究也证实,线粒体转移可以逆转T细胞的命运轨迹,让它们对凋亡等死亡指令,拥有更高的抵抗能力。另外,如果将线粒体提供给能特异性抗癌的CAR-T细胞,这些细胞将会在人体存活更长的时间,发挥更强的抗癌能力。
巴西里约热内卢国家癌症研究所(INCA)的研究员、文章的共同作者之一Martín Hernán Bonamino表示,这就像是将一辆标准轿车改造成一辆赛车。那些接受了线粒体的CAR-T细胞不仅生存率提高,还具备了最佳的性能,能更有效地攻击癌细胞。
总的来说,一个最关键的决定因素是线粒体的结构和功能是否正常,而这和线粒体DNA的突变密切相关。大约60%的癌症病例发生在65岁及以上的患者中,而线粒体DNA发生累积损伤的可能性是核DNA的10倍。因此,癌症患者线粒体DNA中累积突变,可能会更多,而他们的线粒体是否正常,能否都发挥该有的作用,或许还是一个值得深入探究的问题。另外,研究人员较为担忧的一点是,在现有的转移过程中,线粒体转移率较低,大约为10%左右,这可能会影响这一方式后续在临床上的相关应用。
参考链接:
https://medicalxpress.com/news/2024-10-cellular-power-stem-cells-lifeline.html
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-024-05627-4
https://www.cell.com/cell/fulltext/S0092-8674(24)00956-5
https://www.nature.com/articles/s41565-021-01000-4
]]>